Wiadomości ogólne
- Czas trwania zajęć: 45 minut
- Pojęcia kluczowe:
- elektrolit,
- nieelektrolit,
- dysocjacja elektrolityczna,
- prąd,
- jony.
- Hipoteza sformułowana przez uczniów:
- Niektóre substancje przewodzą prąd elektryczny.
- Produkty spożywcze przewodzą prąd elektryczny.
Doświadczenie
- Potrzebne materiały, przyrządy:
- Zadanie A
4 zlewki (50cm3), elektrody miedziane, płaska bateria (4,5V), dioda, cukier, kwas solny, wodorotlenek sodu, woda destylowana.
- Zadanie B
4 cytryny, nóż, gwoździe miedziane, gwoździe ocynkowane, miedziany przewód, dioda LED.
- Uwagi dotyczące BHP:
Doświadczenia należy wykonywać z zachowaniem odpowiednich środków bezpieczeństwa. Niezbędny jest kitel, okulary ochronne oraz rękawice.
Wodorotlenek sodu:
R35 Powoduje poważne oparzenia.
S1/2 Przechowywać pod zamknięciem i chronić przed dziećmi.
S26 Zanieczyszczone oczy przemyć natychmiast dużą ilością wody i zasięgnąć porady lekarza.
S37/39 Nosić odpowiednie rękawice ochronne i okulary lub ochronę twarzy.
S45 W przypadku awarii lub jeżeli źle się poczujesz, niezwłocznie zasięgnij porady lekarza — jeżeli to możliwe, pokaż etykietę.
Kwas solny:
R 34 Powoduje oparzenia.
R 37 Działa drażniąco na drogi oddechowe.
S26 Zanieczyszczone oczy przemyć natychmiast dużą ilością wody i zasięgnąć porady lekarza.
S37/39 Nosić odpowiednie rękawice ochronne i okulary lub ochronę twarzy.
S45 W przypadku awarii lub jeżeli źle się poczujesz, niezwłocznie zasięgnij porady lekarza — jeżeli to możliwe, pokaż etykietę.
- Zmienne występujące w doświadczeniu:
Zadanie A
- zmienna zależna (co badamy?): przewodnictwo elektryczne, świecenie się diody,
- zmienna niezależna (co zmieniamy?): rodzaj roztworu,
- zmienna kontrolna (czego nie zmieniamy?): objętości roztworów i napięcia prądu.
Zadanie B
- zmienna zależna: świecenie się diody,
- zmienna niezależna:
- zmienna kontrolna: rodzaj owocu i gwoździ.
Instrukcja wykonania doświadczenia:
Zadanie A:
Montujemy zestaw do przewodnictwa prądu elektrycznego składającego się z: elektrod miedzianych, płaskiej baterii (4,5V) i diody. Do czterech zlewek (50cm3) wlewamy po 20cm3: I – 0,1M roztwór wodorotlenku sodu; II – roztwór kwasu solnego; III – roztwór cukru w wodzie destylowanej; IV – woda destylowana.
Badamy przewodnictwo.
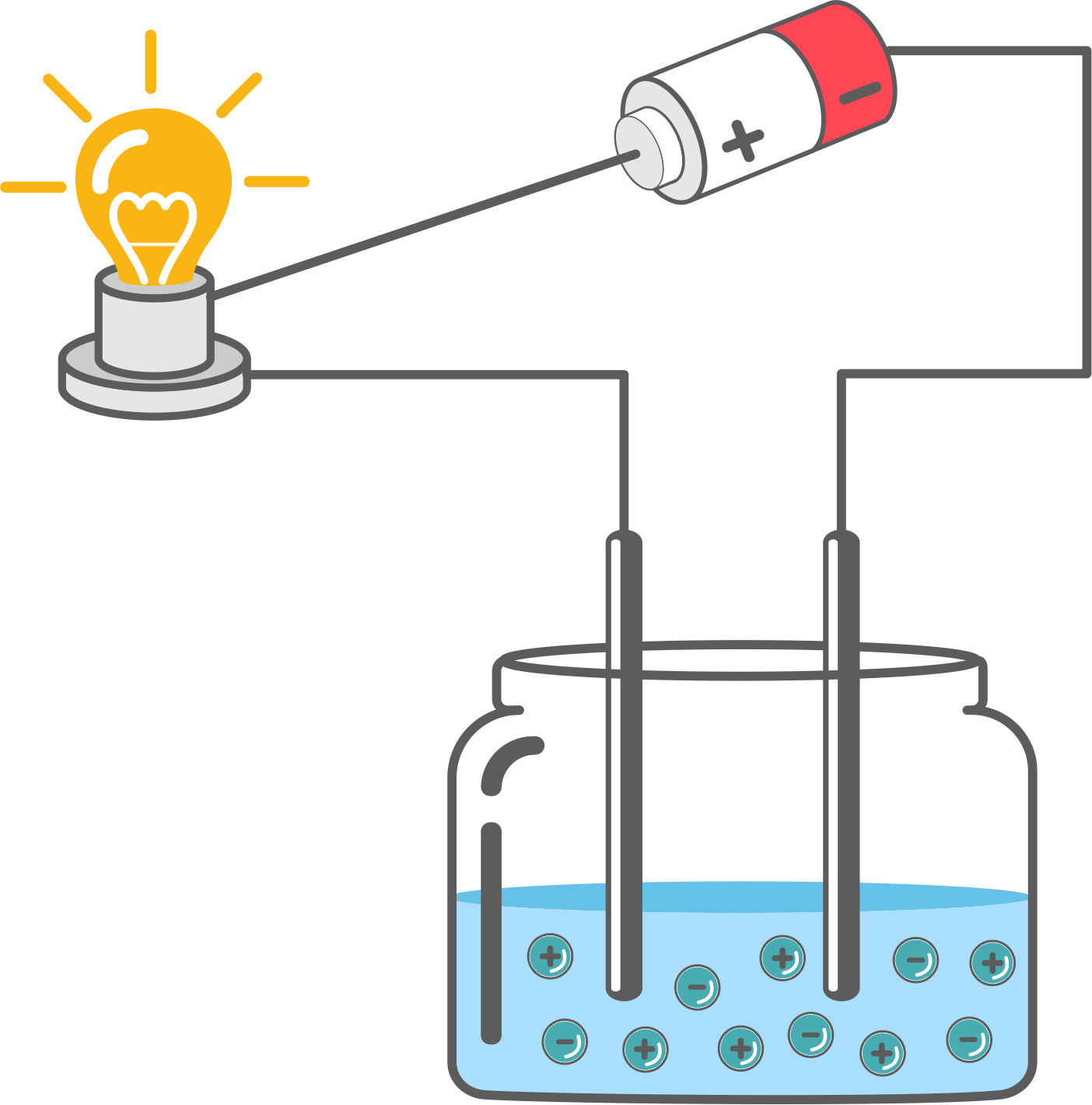
Obserwacje: Żarówka zapaliła się w próbce I i II. Nie zapaliła się w próbce III i IV.
Wnioski: Roztwory wodorotlenku sodu i kwasu solnego przewodzą prąd elektryczny. Substancje, które przewodzą prąd w roztworach wodnych, nazywamy elektrolitami. Roztwór cukru i woda destylowana nie przewodzą prądu elektrycznego. Substancje, które w roztworach wodnych nie przewodzą prądu elektrycznego, nazywamy nieelektrolitami.
| Badana substancja | Obserwacje | Wnioski |
| Roztwór NaOH | ||
| Roztwór HCl | ||
| Roztwór cukru | ||
| Woda destylowana |
Zadanie B
Cztery cytryny przekrajamy na pół i wbijamy w nie gwóźdź miedziany i ocynkowany. Następnie gwoździe łączymy ze sobą szeregowo używając miedzianego przewodu i diody LED.
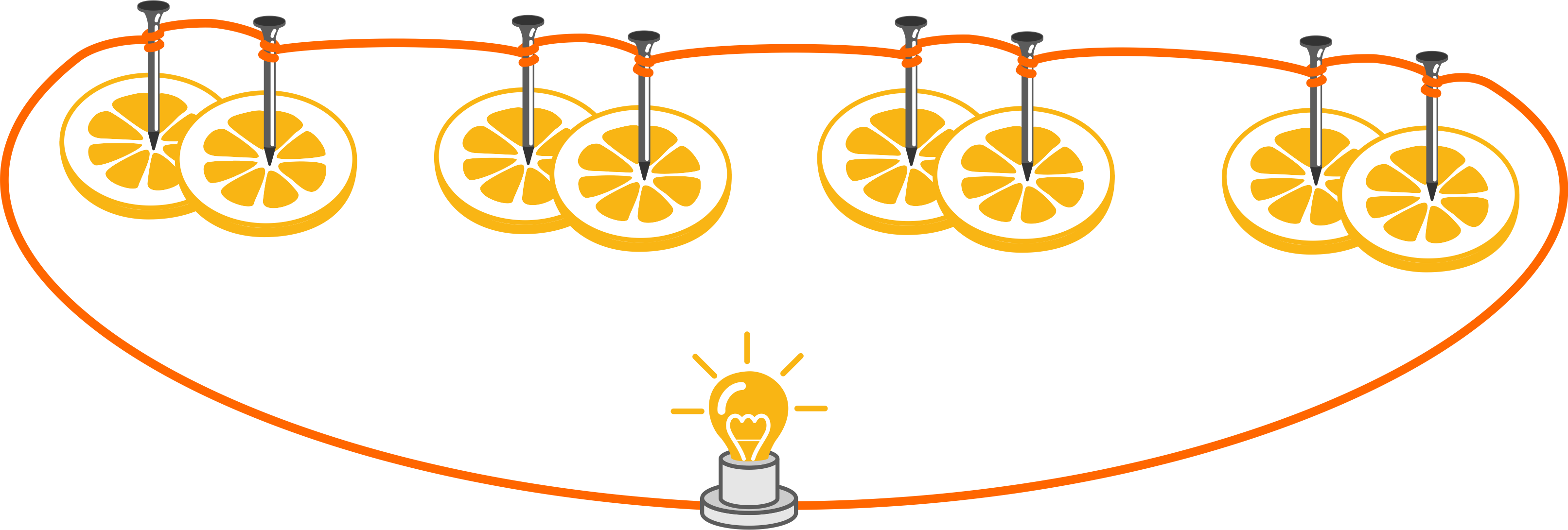
Obserwacje: Po podłączeniu obwodu do diody LED, ta zapaliła się.
Wnioski: W cytrynie znajduje się elektrolit, który przewodzi prąd elektryczny (sok z cytryny to wodny roztwór kwasów).
- Wniosek ogólny:
Proces, w którym cząsteczki związków chemicznych rozpadają się na jony pod wpływem rozpuszczalnika, nazywamy dysocjacją elektrolityczną. Dysocjacji ulegają związki z wiązaniem jonowym lub kowalencyjnym silnie spolaryzowanym. Działanie wody polega na uwalnianiu jonów z sieci krystalicznych związków jonowych lub tworzeniu jonów z cząsteczek o wiązaniu polarnym. Powstające jony mogą mieć charakter dodatni (kationy) lub ujemny (aniony). Dysocjacja jest procesem samorzutnym. Prąd wymusza uporządkowaną wędrówkę jonów.
- Podsumowania doświadczenia:
- Co to są elektrolity? (Substancje, które w roztworach wodnych przewodzą prąd elektryczny).
- Jakie substancje zaliczamy do elektrolitów? (Kwasy, zasady i sole rozpuszczalne w wodzie).
- Co to są nieelektrolity? (Substancje, które w roztworach wodnych nie przewodzą prądu elektrycznego).
- Jakie substancje zaliczamy do nieelektrolitów? (Alkohole, cukry, wodę destylowaną).
- Co to jest dysocjacja elektrolityczna? (Samorzutny proces, w którym dochodzi do rozpadu cząsteczek na jony pod wpływem wody).
- Podaj nazwę anionu i kationu powstałego podczas dysocjacji elektrolitycznej kwasu siarkowego(VI). (Anion siarczanowy(VI) i kation wodorowy).
Podstawa programowa
- Cele, które zostaną osiągnięte w wyniku przeprowadzenia doświadczenia przez nauczyciela i uczniów pod kierunkiem nauczyciela:
a) wymagania ogólne – cele
- uczeń klasyfikuje i definiuje elektrolity oraz nieelektrolity;
- wyjaśnia na czym polega proces dysocjacji elektrolitycznej.
b) wymagania szczegółowe - treści nauczania
- doświadczalnie sprawdza, które z substancji można zaliczyć do elektrolitów, a które do nieelektrolitów;
- zapisuje równanie reakcji dysocjacji jonowej wybranych kwasów, zasad oraz soli;
- samodzielnie konstruuje obwód elektryczny;
- bada przepływ prądu przez roztwór badanej substancji.
Materiały do pobrania
Słowniczek
EKSPERYMENT, prowadzony zgodnie z metodą naukową, rozumiany jest jako proces, w trakcie którego badacz, uczeń, wprowadza zaplanowaną zmianę jednego czynnika i bada, jakie ta zmiana przynosi rezultaty, uważając przy tym, by pozostałe czynniki pozostały niezmienne.
OBSERWACJA rozumiana jako zaplanowane gromadzenie faktów, bez wprowadzania jakichkolwiek ingerencji w badane zjawisko. W trakcie obserwacji nie występuje zmienna niezależna, ponieważ nie ingerujemy w badany proces.
Eksperyment i obserwacja są realizowane zgodnie z metodą naukową, a to oznacza:
Postawienie PYTANIA BADAWCZEGO - Pytanie może być zadane przez uczniów lub zaproponowane przez nauczyciela. Pozwala to ukierunkować myśli i skoncentrować się na badanym problemie, uświadamia, że badania naukowe są wynikiem zaplanowanego działania.Dobrze skonstruowane pytanie badawcze jest pytaniem otwartym - uczeń sam chce znaleźć na nie odpowiedź.
Kolejnym krokiem jest postawienie HIPOTEZY, czyli prawdopodobnej, przewidywanej i wymyślonej przez uczniów odpowiedź na pytanie badawcze. Pamiętajmy, że przed wykonaniem eksperymentu nie ma złych lub dobrych hipotez, każda, nawet najbardziej śmiała jest dopuszczalna.
Kolejny etap to określenie ZMIENNYCH:
- ZMIENNA NIEZALEŻNA czyli to, co zmieniamy.
- ZMIENNA ZALEŻNA czyli wielkość, którą będziemy mierzyć, obserwować.
- ZMIENNE KONTROLNE czyli wszystko to, co musi zostać niezmienne.
ZMIENNA ZALEŻNA to parametr mierzony podczas doświadczenia, zmieniający się w zależności od zmian ZMIENNEJ NIEZALEŻNEJ.
W doświadczeniu naukowym pojawiają się również PRÓBY KONTROLNE. Bez kontroli nie można jednoznacznie stwierdzić, czy wyniki doświadczenia są wiarygodne. Kontrola pozytywna to dodatkowa próba, którą przeprowadzamy identycznie, jak próbę badawczą, ale z użyciem takiego czynnika (jeśli jest znany), który na pewno wywołuje pożądany efekt. Z kolei kontrola negatywna to dodatkowa próba, ale bez użycia czynnika, o którym wiemy, że wywołuje badane zjawisko. Z założenia, wynikiem tej próby będzie brak zmiany mierzonego parametru. Nie w każdym układzie doświadczalnym da się zaplanować obie próby kontrolne.
Zajęcia z pytaniem problemowym zakładają dyskusję między uczniami na podstawie dodatkowych pytań lub przykładów dostarczonych przez nauczyciela. Zajęcia te kształcą umiejętność doboru i formułowania argumentów, słuchania osób o innym stanowisku oraz wyciągania wniosków. W wyniku dyskusji cenne byłoby wypracowanie stanowiska, by uczniowie przekonali się, że każda konstruktywna rozmowa powinna zakończyć się rzetelnym podsumowaniem.
Gry dydaktyczne wykorzystują czynnik zabawy, co wspomaga przyswajanie wiedzy przez uczniów. Gry rozwijają pomysłowość, aktywność, samodzielność, umiejętność pracy w grupie oraz uczą radzenia sobie z emocjami. Grając uczymy się przez działanie i przeżywanie. Sukcesem jest osiągnięcie celu, a nie wygrana z innymi, czy zajęcie pierwszego miejsca. Najważniejsza w grze jest dydaktyka. Wygrywać mają wszyscy.
Bibliografia
- Chemia w gimnazjum, WSiP, Z. Kluz, K. Łopata, Warszawa 1999.
- Chemia – podręcznik dla gimnazjum, OPERON, M. Szczepaniak, J. Waszczuk, Gdynia 2010.
- Chemia ogólna i nieorganiczna, Nowa Era, M. Litwin, Sz. Styka-Wlazło, Warszawa 2002.