Wiadomości ogólne
- Czas trwania zajęć: 45 minut
- Pojęcia kluczowe:
- elektroliza,
- elektrody,
- katoda,
- anoda,
- potencjał ujemny,
- potencjał dodatni,
- utlenianie,
- redukcja.
- Hipoteza sformułowana przez uczniów:
- Elektroliza jest to proces, w którym istotną rolę ma prąd elektryczny.
Doświadczenie
- Potrzebne materiały, przyrządy:
- Zadanie A
Bateria, nóż, woda, soda oczyszczona, 2 przewody z odizolowanymi końcami, taśma izolacyjna, płaska bateria (4,5V), 2 probówki, zlewka, zapałki, żarzące łuczywko.
- Zadanie B
Plastikowe naczynie z dwoma otworami, 2 gumowe korki, 2 elektrody grafitowe, 2 przewody odizolowane na końcach, 2 probówki, woda destylowana, chlorek sodu, fenoloftaleina, płaska bateria (4,5V), zapałki.
- Zadanie C
Płaska bateria (4,5V), 2 elektrody grafitowe, 2 przewody odizolowane na końcach, woda destylowana, zlewka, jodek potasu, skrobia, fenoloftaleina, tektura.
- Uwagi dotyczące BHP:
Należy zachować szczególną ostrożność podczas podłączania obwodu do źródła prądu. Wykorzystywane substancje chemiczne są bezpieczne, jednak należy założyć odzież ochronną, okulary oraz rękawice.
Chlor:
R23 - Działa toksycznie przez drogi oddechowe.
R36/37/38 - Działa drażniąco na oczy, drogi oddechowe i skórę.
R50 - Działa bardzo toksycznie na organizmy wodne.
- Zmienne występujące w doświadczeniu:
- zmienna zależna (co badamy?): właściwości gazów, zabarwienie roztworu,
- zmienna niezależna (co zmieniamy?): rodzaj elektrolitu,
- zmienna kontrolna (czego nie zmieniamy?): napięcie elektryczne.
Instrukcja wykonania doświadczenia:
Zadanie A:
Elektroliza wody domowym sposobem.
Do zlewki wlewamy wodę i dodajemy niewielką ilość sody oczyszczonej (pomaga w przewodnictwie prądu). Następnie baterię przecinamy w połowie i wyjmujemy z niej elektrody grafitowe. Z przygotowanych końców przewodów ściągamy izolację, owijamy je wokół elektrod i umacniamy je za pomocą taśmy izolacyjnej. Natomiast drugi koniec przewodu podłączamy do baterii (4,5V) i również przymocowujemy go za pomocą taśmy izolacyjnej. Do dwóch probówek wlewamy roztwór wody z sodą oczyszczoną, umieszczamy w nich elektrody i zanurzamy (do góry dnem) w uprzednio przygotowanej zawartości zlewki. Sprawdzamy jaki gaz znajduje się w probówce z elektrodą podłączoną do minusa przez zapalenie zapałki u wylotu probówki, natomiast do probówki z elektrodą podłączoną do plusa przez włożenie żarzącego się łuczywa.
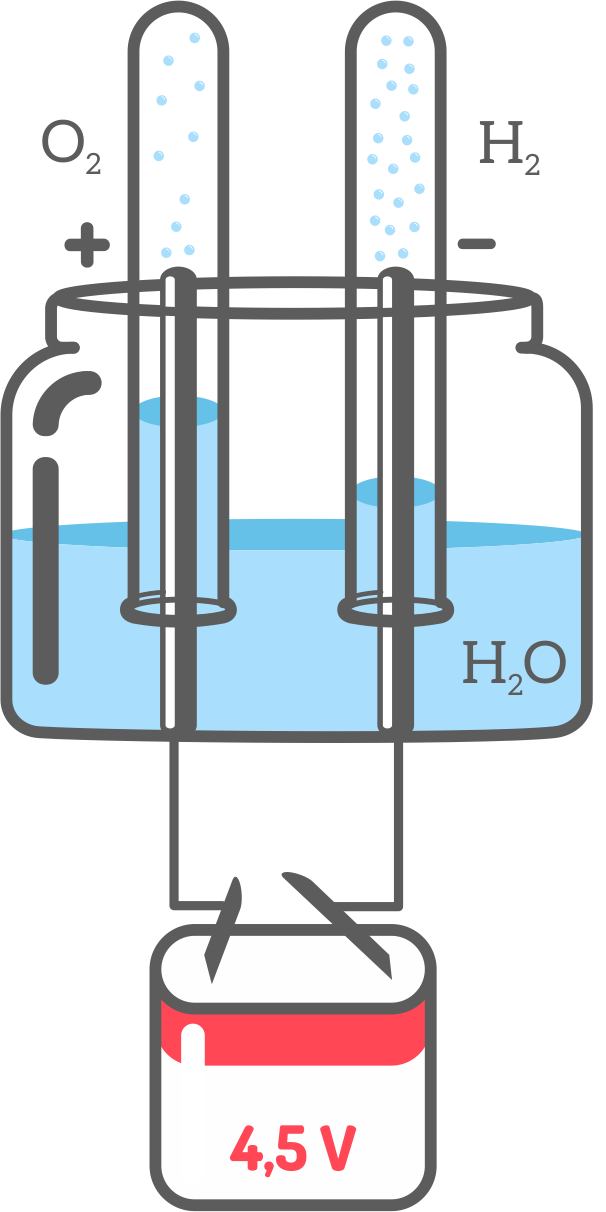
Obserwacje: W pierwszej próbie (probówka będąca nad katodą) słychać charakterystyczne szczeknięcie, natomiast w drugiej próbie (probówka będąca nad anodą) żarzące łuczywko zaczyna się mocniej palić.
Wnioski: Charakterystyczne szczeknięcie świadczy o obecności wydzielającego się wodoru, natomiast wzmożone palenie o obecności tlenu.
Reakcje zachodzące:
K(-) redukcja 2H2O + 2e- → H2 + 2OH- /*2
A(+) utlenianie 2H2O → O2 + 4e- + 4H+
Sumarycznie: 2H2O → 2H2 + O2
Ilość wydzielonego wodoru jest dwa razy większa.
Zadanie B:
Napełniamy elektrolizer (plastikowe naczynie, w którym znajdują się dwa otwory, przez które przechodzą elektrody grafitowe w dopasowanych gumowych korkach. Elektrody umieszczone są w probówkach do góry dnem) roztworem chlorku sodu i wkraplamy niewielką ilość fenoloftaleiny. Elektrody podłączamy ze źródłem stałego napięcia (płaska bateria 4,5V). Elektrolizę prowadzimy do momentu, w którym otrzymamy po ok. 15cm3 gazu. Po skończonej elektrolizie obserwujemy zabarwienie roztworu oraz przystawiamy zapałkę do wylotu probówki, w celu identyfikacji gazu.
Obserwacje: Roztwór zabarwia się na malinowo. Podczas przystawienia zapałki do wylotu probówki słychać charakterystyczne szczeknięcie.
Wnioski: W trakcie elektrolizy na katodzie wydzielił się wodór, a na katodzie chlor. Roztwór przyjął malinowe zabarwienie w pobliżu katody, co świadczy o jego zasadowym odczynie.
Reakcje zachodzące:
K(-) redukcja 2H2O + 2e- → H2 + 2OH-
A(+) utlenianie2Cl- + 2e- → Cl2
Sumarycznie: 2Cl- + 2H2O → H2 + Cl2 + 2OH-
Zadanie C:
Budujemy układ złożony ze źródła prądu (płaska bateria typu 3R12 – 4,5V) i dwóch elektrod grafitowych. Przepłukane wodą destylowaną elektrody zanurzamy w elektrolizerze (zlewka), w którym znajduje się roztwór jodku potasu z dodatkiem skrobi oraz fenoloftaleiny. Elektrody oddzielamy między sobą dopasowaną przegrodą z tektury. Obserwujemy zachodzące zmiany.
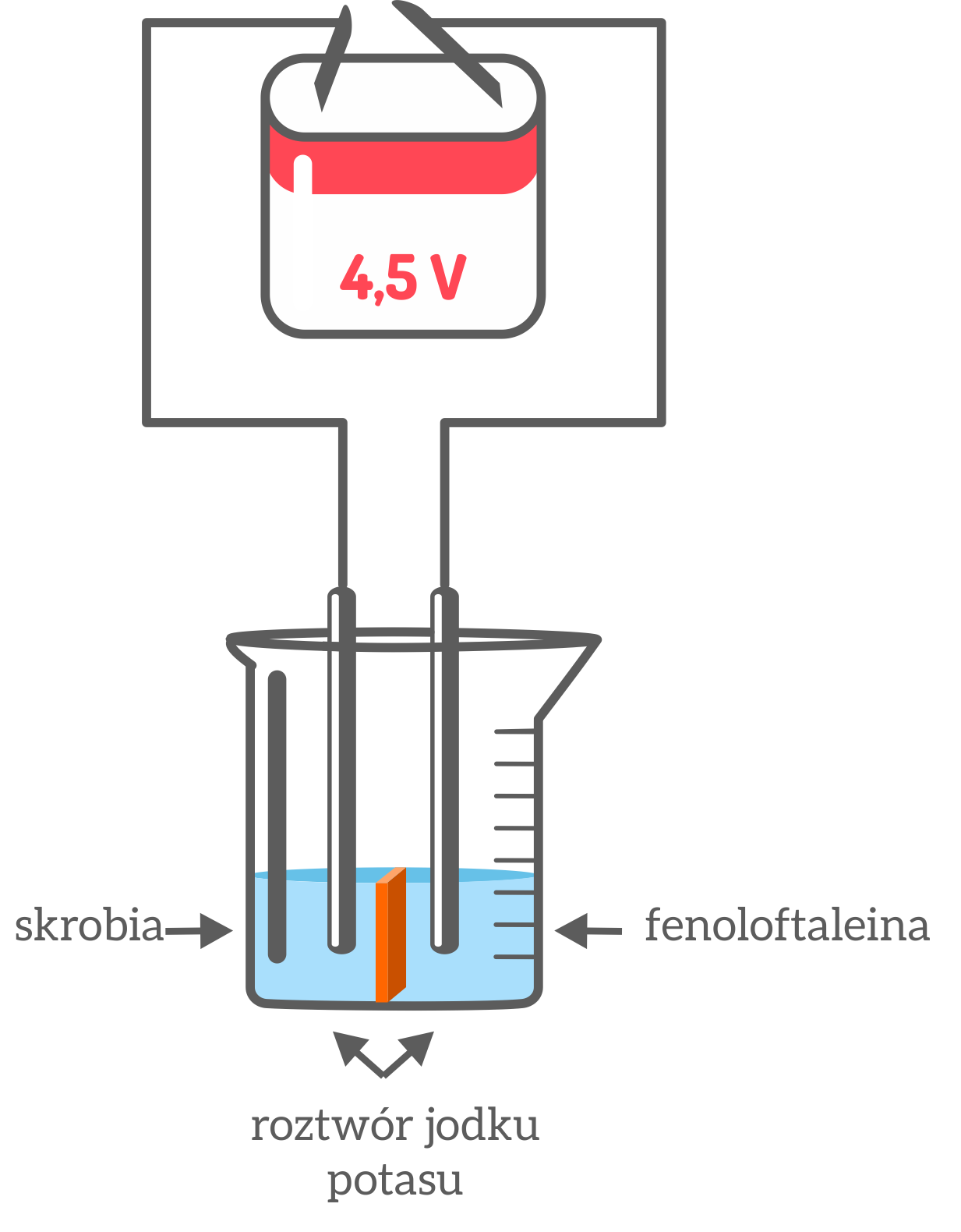
Obserwacje: Po jednej z przedzielonych stron pojawia się granatowe zabarwienie, a po drugiej malinowe zabarwienie.
Wnioski: W trakcie elektrolizy na katodzie wydzielił się wodór, a na anodzie jod. Roztwór przybrał granatowe zabarwienie w pobliżu anody, a malinowe w pobliżu katody.
Reakcje zachodzące:
K(-) redukcja 2H2O + 2e- → H2 + 2OH-
A(+) utlenianie2I- → I2 + 2e-
Sumarycznie: 2I- + 2H2O → I2 + H2 + 2OH-
- Wniosek ogólny:
Elektroliza są to przemiany chemiczne, które zachodzą na elektrodach pod wpływem przepływającego prądu elektrycznego przez elektrolit. W elektrolizie, odwrotnie niż w ogniwach galwanicznych, anoda to elektroda połączona z dodatnim biegunem źródła napięcia, natomiast katoda –to elektroda połączona z ujemnym biegunem źródła napięcia. Niezmienne jest to, że na anodzie zawsze zachodzi proces utleniania, a na katodzie redukcji. Podczas opisanych doświadczeń przeprowadzona została elektroliza w wodnych roztworach soli, podczas której w elektrolizie bierze udział także woda. Istnieje również elektroliza stopionych soli, która umożliwia otrzymywanie czystych metali i ich związków. Procesy te wykorzystywane są na szeroką skalę w przemyśle, np. galwanotechnika – proces, w którym pokrywa się metalowe przedmioty warstwą innego metalu (powłoka galwaniczna) w celach ochronnych, np. przed korozją.
- Podsumowania doświadczenia:
- Co to jest elektroliza? (Zespół przemian chemicznych zachodzących na elektrodach pod wpływem prądu stałego przepływającego przez elektrolit).
- Jaka jest różnica między ogniwem galwanicznym, a elektrolizą? (W elektrolizie anoda połączona jest z dodatnim biegunem źródła napięcia, a katoda z ujemnym – odwrotnie niż w ogniwie galwanicznym).
- Jakie są podobieństwa między ogniwem galwanicznym, a elektrolizą? (Na anodzie zawsze zachodzi proces utleniania, a na katodzie proces redukcji).
- Jakie gazy wydzielają się podczas elektrolizy wody? (Na katodzie wydziela się wodór, a na anodzie tlen. Tlenu jest dwukrotnie mniej).
- Jakie jest zastosowanie elektrolizy w przemyśle? (Otrzymywanie czystych metali oraz ich związków, galwanotechnika oraz oczyszczanie miedzi hutniczej).
Podstawa programowa
- Cele, które zostaną osiągnięte w wyniku przeprowadzenia doświadczenia przez nauczyciela i uczniów pod kierunkiem nauczyciela:
a) wymagania ogólne – cele
- uczeń wyjaśnia pojęcie elektrolizy;
- uczeń zapisuje równania reakcji zachodzące za katodzie i anodzie.
b) wymagania szczegółowe - treści nauczania
- uczeń dopasowuje ładunek do katody i anody;
- doświadczalnie przeprowadza elektrolizę i identyfikuje produkty reakcji;
- tłumaczy zmianę odczynu przestrzeni przyelektrodowej podczas elektrolizy soli.
Materiały do pobrania
Słowniczek
EKSPERYMENT, prowadzony zgodnie z metodą naukową, rozumiany jest jako proces, w trakcie którego badacz, uczeń, wprowadza zaplanowaną zmianę jednego czynnika i bada, jakie ta zmiana przynosi rezultaty, uważając przy tym, by pozostałe czynniki pozostały niezmienne.
OBSERWACJA rozumiana jako zaplanowane gromadzenie faktów, bez wprowadzania jakichkolwiek ingerencji w badane zjawisko. W trakcie obserwacji nie występuje zmienna niezależna, ponieważ nie ingerujemy w badany proces.
Eksperyment i obserwacja są realizowane zgodnie z metodą naukową, a to oznacza:
Postawienie PYTANIA BADAWCZEGO - Pytanie może być zadane przez uczniów lub zaproponowane przez nauczyciela. Pozwala to ukierunkować myśli i skoncentrować się na badanym problemie, uświadamia, że badania naukowe są wynikiem zaplanowanego działania.Dobrze skonstruowane pytanie badawcze jest pytaniem otwartym - uczeń sam chce znaleźć na nie odpowiedź.
Kolejnym krokiem jest postawienie HIPOTEZY, czyli prawdopodobnej, przewidywanej i wymyślonej przez uczniów odpowiedź na pytanie badawcze. Pamiętajmy, że przed wykonaniem eksperymentu nie ma złych lub dobrych hipotez, każda, nawet najbardziej śmiała jest dopuszczalna.
Kolejny etap to określenie ZMIENNYCH:
- ZMIENNA NIEZALEŻNA czyli to, co zmieniamy.
- ZMIENNA ZALEŻNA czyli wielkość, którą będziemy mierzyć, obserwować.
- ZMIENNE KONTROLNE czyli wszystko to, co musi zostać niezmienne.
ZMIENNA ZALEŻNA to parametr mierzony podczas doświadczenia, zmieniający się w zależności od zmian ZMIENNEJ NIEZALEŻNEJ.
W doświadczeniu naukowym pojawiają się również PRÓBY KONTROLNE. Bez kontroli nie można jednoznacznie stwierdzić, czy wyniki doświadczenia są wiarygodne. Kontrola pozytywna to dodatkowa próba, którą przeprowadzamy identycznie, jak próbę badawczą, ale z użyciem takiego czynnika (jeśli jest znany), który na pewno wywołuje pożądany efekt. Z kolei kontrola negatywna to dodatkowa próba, ale bez użycia czynnika, o którym wiemy, że wywołuje badane zjawisko. Z założenia, wynikiem tej próby będzie brak zmiany mierzonego parametru. Nie w każdym układzie doświadczalnym da się zaplanować obie próby kontrolne.
Zajęcia z pytaniem problemowym zakładają dyskusję między uczniami na podstawie dodatkowych pytań lub przykładów dostarczonych przez nauczyciela. Zajęcia te kształcą umiejętność doboru i formułowania argumentów, słuchania osób o innym stanowisku oraz wyciągania wniosków. W wyniku dyskusji cenne byłoby wypracowanie stanowiska, by uczniowie przekonali się, że każda konstruktywna rozmowa powinna zakończyć się rzetelnym podsumowaniem.
Gry dydaktyczne wykorzystują czynnik zabawy, co wspomaga przyswajanie wiedzy przez uczniów. Gry rozwijają pomysłowość, aktywność, samodzielność, umiejętność pracy w grupie oraz uczą radzenia sobie z emocjami. Grając uczymy się przez działanie i przeżywanie. Sukcesem jest osiągnięcie celu, a nie wygrana z innymi, czy zajęcie pierwszego miejsca. Najważniejsza w grze jest dydaktyka. Wygrywać mają wszyscy.
Bibliografia
- Chemia ogólna i nieorganiczna, Nowa Era, M. Litwin, Sz. Styka-Wlazło, J. Szymońska, Warszawa 2004.