Wiadomości ogólne
- Czas trwania zajęć: 45 minut
- Pojęcia kluczowe:
- szybkość reakcji chemicznej,
- temperatura,
- zderzenia cząsteczek,
- energia cząsteczek.
- Hipoteza sformułowana przez uczniów:
- Temperatura, podobnie jak stężenie oraz stopień rozdrobnienia reagentów, wpływa na szybkość reakcji chemicznej.
- Reakcja chemiczna zachodzi szybciej w podwyższonej temperaturze.
Doświadczenie
- Potrzebne materiały, przyrządy:
- Zadanie A
2 probówki, 2 zlewki o pojemności 500cm3, statyw do probówek, czajnik, pinceta, kostki lodu, rozcieńczony kwas solny, wstążki magnezowe, woda.
- Zadanie B
3 zlewki o pojemności 100cm3, palnik, trójnóg, siatka ze spiekiem ceramicznym, szczypce, 30% roztwór kwasu azotowego(V), 10% roztwór jodku potasu.
- Uwagi dotyczące BHP:
Doświadczenia należy wykonywać z zachowaniem odpowiednich środków bezpieczeństwa. Niezbędny jest kitel, okulary ochronne oraz rękawice.
Kwas solny:
R 34 Powoduje oparzenia.
R 37 Działa drażniąco na drogi oddechowe.
S26 Zanieczyszczone oczy przemyć natychmiast dużą ilością wody i zasięgnąć porady lekarza.
S37/39 Nosić odpowiednie rękawice ochronne i okulary lub ochronę twarzy.
S45 W przypadku awarii lub jeżeli źle się poczujesz, niezwłocznie zasięgnij porady lekarza — jeżeli to możliwe, pokaż etykietę.
Kwas azotowy(V):
R 34 Powoduje oparzenia.
S 23 Nie wdychać pary/rozpylonej cieczy.
S 26 Zanieczyszczone oczy przemyć natychmiast dużą ilością wody i zasięgnąć porady lekarza.
S37/39 Nosić odpowiednie rękawice ochronne i okulary lub ochronę twarzy.
S45 W przypadku awarii lub jeżeli źle się poczujesz, niezwłocznie zasięgnij porady lekarza — jeżeli to możliwe, pokaż etykietę.
- Zmienne występujące w doświadczeniu:
- zmienna zależna: szybkość wydzielania się piany lub zmiana koloru,
- zmienna niezależna: temperatura,
- zmienne kontrolne: stężenie substratów, wielkość rozdrobnienia (stałe).
Instrukcja wykonania doświadczenia:
Zadanie A:
Do dwóch probówek wlewamy 2cm3 rozcieńczonego kwasu solnego (ok. 10%). Jedną z probówek umieszczamy w zlewce z gorącą wodą, natomiast drugą w zlewce z kostkami lodu. Po 3-4 minutach do obu probówek dodajemy po jednej wstążce magnezowej. Obserwujemy zachodzące zmiany.
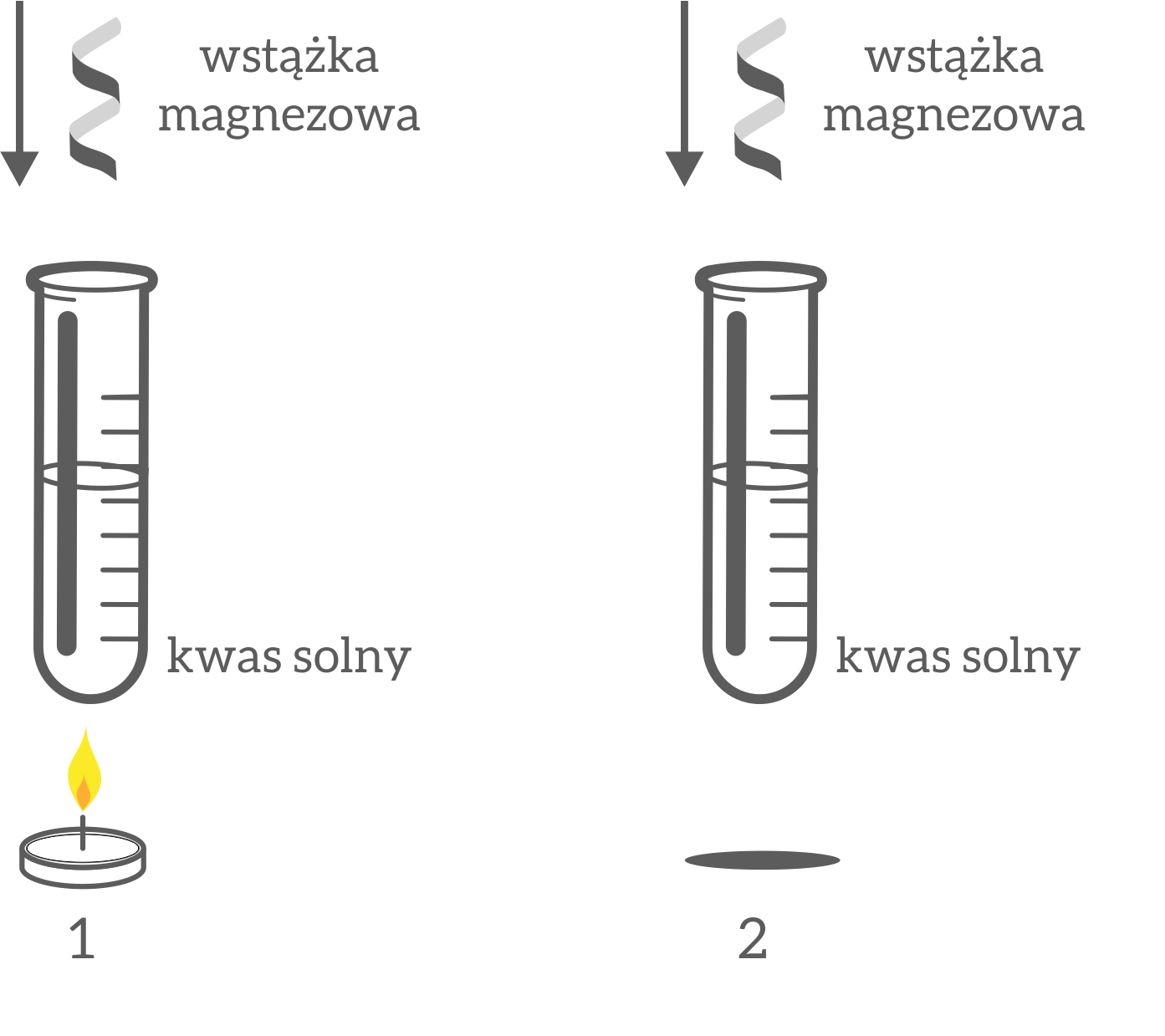
Obserwacje: W probówce nr 1 reakcja przebiegała gwałtowniej (większa ilość piany). Przy wylocie probówki zauważalne były większe ilości gazu.
Wniosek: Temperatura przyspiesza reakcję chemiczną. Obserwowany gaz u wylotu probówki to wodór.
Reakcje zachodzące:
2HCl + Mg → MgCl2 + H2↑
Zadanie B:
Do trzech zlewek o pojemności 100cm3 wlewamy 10cm3 kwasu azotowego. Zlewki ogrzewamy (zlewka nr 1 do 30oC, zlewka nr 2 do 50oC, zlewka nr 3 do 70oC). Następnie jednocześnie wlewamy roztwór jodku potasu do wszystkich zlewek. Obserwujemy zachodzące zmiany.
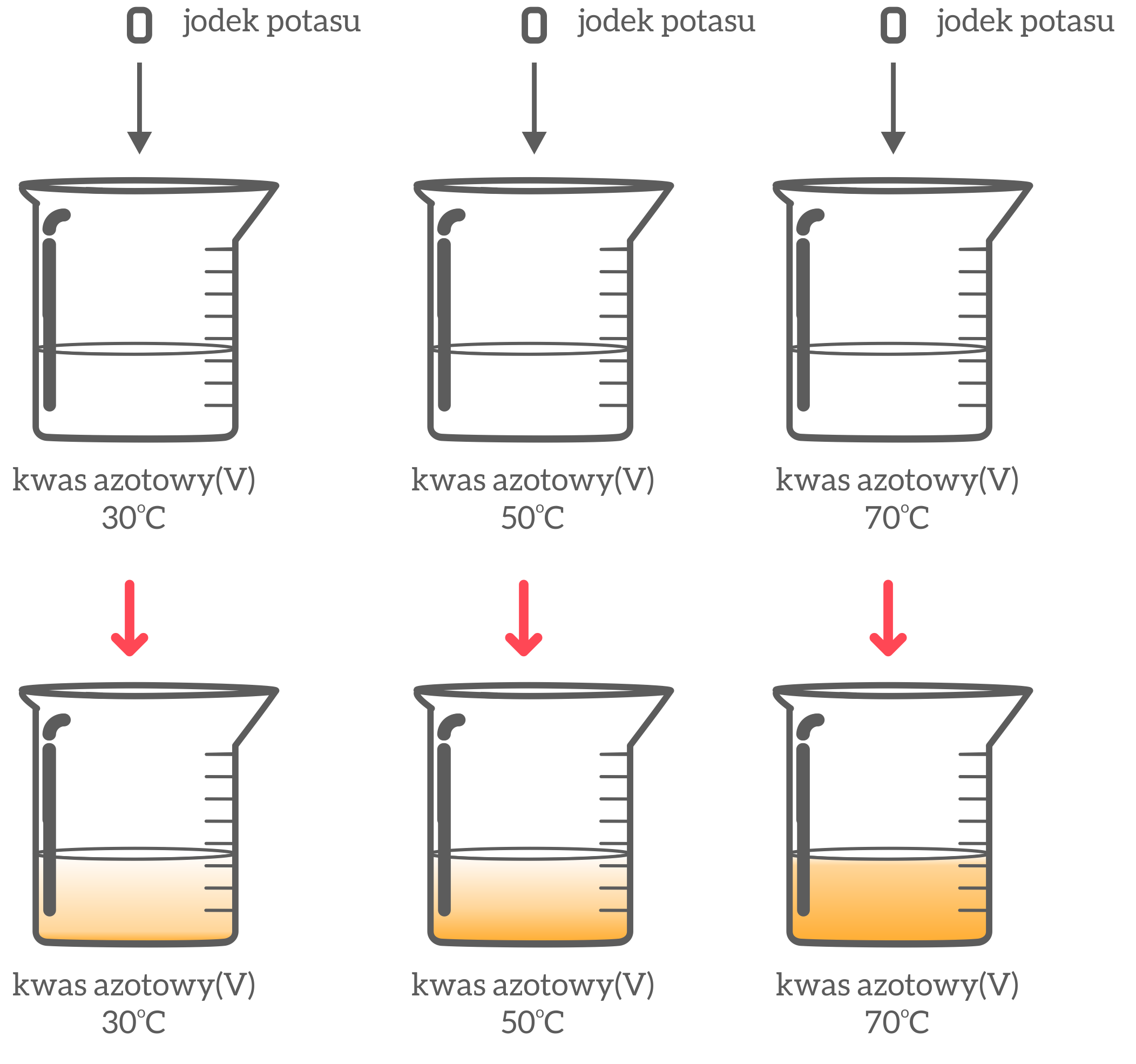
Obserwacje: Zawartość zlewki nr 3 najszybciej zmieniła swój kolor. Widoczne były kłęby brązowego gazu.
Wnioski: Temperatura przyspiesza reakcję chemiczną. Obserwowane kłęby gazu to pary jodu oraz tlenku azotu(IV).
Reakcje zachodzące:
2KI + 4HNO3 → 2KNO3 + I2 + 2NO2 + 2H2O
- Wniosek ogólny:
Im większa temperatura, tym szybciej zachodzi reakcja chemiczna. Podczas ogrzewania cząsteczki substancji zwiększają swoją energię, co powoduje ich wzmożony ruch oraz prawdopodobieństwo zderzeń. Częstsze zderzenia cząsteczek ułatwiają rozerwanie starych wiązań i tworzenie nowych, a w konsekwencji szybszy przebieg reakcji chemicznej.
- Podsumowania doświadczenia:
- Co to jest szybkość reakcji? (Zmniejszanie się stężenia substratów lub przyrost stężenia produktów).
- Czy temperatura ma wpływ na szybkość reakcji chemicznej? (Tak).
- Czy istnieją inne sposoby przyspieszenia zachodzącej reakcji? (Utrwalenie wiadomości - zwiększenie stężenia substratów, stopień rozdrobnienia substratów i ich stan skupienia, stosowanie katalizatora).
- Co dzieje się z cząsteczkami, kiedy podgrzewamy substancję? (Cząsteczki częściej się poruszają i zderzają, rozrywają się stare wiązania i tworzą nowe).
- W naszym otoczeniu nieustannie zachodzą reakcje chemiczne. W jaki sposób możemy je przyspieszyć? (Podgrzewanie potraw).
- A w jaki sposób opóźnić? (Chłodzenie potraw w celu zapobiegania ich rozkładowi).
Podstawa programowa
- Cele, które zostaną osiągnięte w wyniku przeprowadzenia doświadczenia przez nauczyciela i uczniów pod kierunkiem nauczyciela:
a) wymagania ogólne – cele
- uczeń zapoznaje się i utrwala wiedzę na temat kinetyki reakcji chemicznych.
b) wymagania szczegółowe - treści nauczania
- uczeń definiuje pojęcia szybkości reakcji chemicznej;
- wymienia czynniki wpływające na szybkość reakcji chemicznej;
- doświadczalnie sprawdza wpływ temperatury na szybkość reakcji chemicznej;
- samodzielnie wyciąga wnioski i przywołuje przykłady procesów zachodzących w życiu codziennym.
Materiały do pobrania
Słowniczek
EKSPERYMENT, prowadzony zgodnie z metodą naukową, rozumiany jest jako proces, w trakcie którego badacz, uczeń, wprowadza zaplanowaną zmianę jednego czynnika i bada, jakie ta zmiana przynosi rezultaty, uważając przy tym, by pozostałe czynniki pozostały niezmienne.
OBSERWACJA rozumiana jako zaplanowane gromadzenie faktów, bez wprowadzania jakichkolwiek ingerencji w badane zjawisko. W trakcie obserwacji nie występuje zmienna niezależna, ponieważ nie ingerujemy w badany proces.
Eksperyment i obserwacja są realizowane zgodnie z metodą naukową, a to oznacza:
Postawienie PYTANIA BADAWCZEGO - Pytanie może być zadane przez uczniów lub zaproponowane przez nauczyciela. Pozwala to ukierunkować myśli i skoncentrować się na badanym problemie, uświadamia, że badania naukowe są wynikiem zaplanowanego działania.Dobrze skonstruowane pytanie badawcze jest pytaniem otwartym - uczeń sam chce znaleźć na nie odpowiedź.
Kolejnym krokiem jest postawienie HIPOTEZY, czyli prawdopodobnej, przewidywanej i wymyślonej przez uczniów odpowiedź na pytanie badawcze. Pamiętajmy, że przed wykonaniem eksperymentu nie ma złych lub dobrych hipotez, każda, nawet najbardziej śmiała jest dopuszczalna.
Kolejny etap to określenie ZMIENNYCH:
- ZMIENNA NIEZALEŻNA czyli to, co zmieniamy.
- ZMIENNA ZALEŻNA czyli wielkość, którą będziemy mierzyć, obserwować.
- ZMIENNE KONTROLNE czyli wszystko to, co musi zostać niezmienne.
ZMIENNA ZALEŻNA to parametr mierzony podczas doświadczenia, zmieniający się w zależności od zmian ZMIENNEJ NIEZALEŻNEJ.
W doświadczeniu naukowym pojawiają się również PRÓBY KONTROLNE. Bez kontroli nie można jednoznacznie stwierdzić, czy wyniki doświadczenia są wiarygodne. Kontrola pozytywna to dodatkowa próba, którą przeprowadzamy identycznie, jak próbę badawczą, ale z użyciem takiego czynnika (jeśli jest znany), który na pewno wywołuje pożądany efekt. Z kolei kontrola negatywna to dodatkowa próba, ale bez użycia czynnika, o którym wiemy, że wywołuje badane zjawisko. Z założenia, wynikiem tej próby będzie brak zmiany mierzonego parametru. Nie w każdym układzie doświadczalnym da się zaplanować obie próby kontrolne.
Zajęcia z pytaniem problemowym zakładają dyskusję między uczniami na podstawie dodatkowych pytań lub przykładów dostarczonych przez nauczyciela. Zajęcia te kształcą umiejętność doboru i formułowania argumentów, słuchania osób o innym stanowisku oraz wyciągania wniosków. W wyniku dyskusji cenne byłoby wypracowanie stanowiska, by uczniowie przekonali się, że każda konstruktywna rozmowa powinna zakończyć się rzetelnym podsumowaniem.
Gry dydaktyczne wykorzystują czynnik zabawy, co wspomaga przyswajanie wiedzy przez uczniów. Gry rozwijają pomysłowość, aktywność, samodzielność, umiejętność pracy w grupie oraz uczą radzenia sobie z emocjami. Grając uczymy się przez działanie i przeżywanie. Sukcesem jest osiągnięcie celu, a nie wygrana z innymi, czy zajęcie pierwszego miejsca. Najważniejsza w grze jest dydaktyka. Wygrywać mają wszyscy.
Bibliografia
- Chemia, WSiP, M. Późniczek, Z. Kluz, Warszawa 2002.
- Chemia ogólna i nieorganiczna, Nowa Era, M. Litwin, Sz. Styka-Wlazło, Warszawa 2002.
- http://www.mt.com.pl/szybkosc-reakcji-chemicznych